患者故事
郑嫒一直致力于公益管理的深入学习,如今的她怀揣着爱与希望带领着紫贝壳公益,一直走在罕见病治愈的路上。
我们非常重视您的个人隐私,当您访问我们的网站时,请同意使用的所有cookie。有关个人数据处理的更多信息可访问《隐私政策》
我们设计开展研究保证了患者安全性、数据完整性、监管合规性和科学严谨性。通过我们的综合开发战略,客户可以更好地处理这些关键点以及其它所关注的问题。这些战略让我们把患者需求放在第一位的同时,在规定的时间和预算内减轻了客户的负担和风险,实现高效运营。
研究数据显示,纳入患者视角的试验方案可增加药物成功上市的几率。这也是我们在进行试验设计时考虑患者需求和偏好的原因之一。通过移除参与试验的障碍,我们加快了研究入组,提高了患者的依从性,创建了更有说服力的价值故事。



我们的问题解决专家
现今,临床试验的设计和执行模式在不断发生着演变,因此在做任何一个决策时都需要有生物统计学、数据分析和数据管理方面的强大专业能力作为支撑。此外,试验方案的灵活调整也已成为常态。上述的一切对于确保患者的安全、数据完整性和操作可行性至关重要。
从客户的方案设计、试验执行、研究中心管理、一直到产品的市场战略和商业化,精鼎医药可提供全方位的专业支持。我们采取以风险为重点的方法,不断评估试验的实际风险,以便我们能够管控与适应它,保证试验顺利进行。
为了开展以患者为中心的研究,我们在80%的II-III期试验中纳入了智能远程临床试验元素。
客户需要在真实世界中研究一个疗法或疾病所产生的影响,生成充分的循证医学证据,同时避免给患者带来额外负担。我们的真实世界证据(RWE)策略旨在向支付方、监管机构、医疗机构和患者确保,他们临床试验的结果在真实世界研究中得到了充分的印证。我们会让产品的价值在其上市之前、上市期间和上市之后都能充分体现。
为了获得研究所需的患者,我们会将远程智能临床试验(DCT)元素纳入我们的提案中。
许多患者在参加临床试验时会面临很多阻碍,比如对研究信息了解不够、医学检查访视的时间和地点对受试者不便利等。这就导致一些患者群体失去了接受新疗法的机会,且研究本身也缺乏确保广泛有效性所需的患者多样性。
我们关注患者接触和参与的临床试验的实际问题。我们会进行广泛的受试者招募并在整个研究过程中追踪适当的人口多样性。通过了解患者偏好并与他们保持合适的沟通,可以帮助客户招募并保留所需的多样化的受试人群。
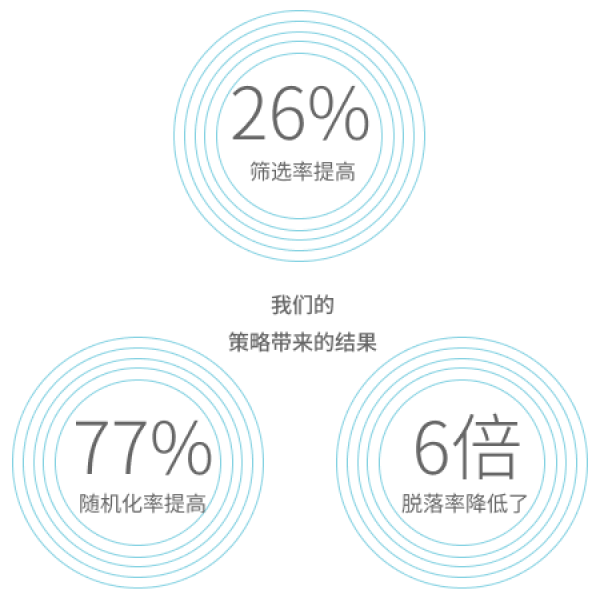
在对30000多名患者进行的90多项皮肤药临床研究中,我们的患者教育和参与策略提高了研究的筛选率、实现了入组优化、降低了脱落率。
为了应对试验方案的日益复杂性以及研究中心面临的压力,我们将帮您找到合适的研究中心、患者和合作方来加快研究启动。我们的多学科卓越启动团队将根据研究的具体需求为客户提供研究计划、关键路径的把控和交付执行等主要支持。我们还与可提供广泛视角的团体建立合作关系,从而让我们在进行方案设计和研究中心的选择时能更大程度地考虑到利益相关方的需求。

我们的临床研究中心联盟可让客户接触到更多的研究中心、多样化的患者群体及丰富的研究者资源,从而让您找到最合适的研究中心。
在开发过程的关键节点上掌控监管路径,降低合规风险,从而简化并加快产品的开发进程,使患者能得到治疗。
在监管机构拥有工作经历的全球专家团队将帮助客户制定他们需达到的标准。我们将帮助您优化审批途径,实现产品价值的更大化。
曾在美国FDA、欧洲药品管理局EMA和中国NMPA工作过的精鼎专家将在1000多名本地法规团队同事的支持下,帮助您在不断变化的监管环境中处理复杂的全球注册事务。
即使有完美的临床试验执行和强有力的法规策略,也无法保证产品最终能够成功上市。如果没有针对商业化的有力规划,患者可及性和投资回报率(ROI)最终都会受到影响。
我们将帮助客户制定产品的市场准入策略来解决这一问题。为此,我们将提供产品市场准入策略,将临床和开发计划与监管和卫生经济策略相结合。
我们的市场准入团队拥有丰富的经验和专业知识能帮助客户提升ROI和患者可及性。在过去10年中我们共完成了150多个市场准入战略规划项目。
为了充分利用您的宝贵数据,我们设计了符合目的的技术解决方案,这些解决方案采用了我们成熟的系统以及拥有一流技术、业界领先的供应商。每个解决方案都由专家设计和实施,以满足您的试验和团队的特定需求。
我们的解决方案不仅仅限于数据收集。我们会了解您的团队将面临的决策,然后创建方法帮您实现数据的生成、可视化和监控,以让您能够快速、自信地做出决策。
凭借在全球范围内使用先进技术规划、运营和交付远程智能临床试验(DCT)方面的优异表现,精鼎医药荣获2022年Frost&Sullivan全球客户价值领导力奖。
无论是开展小型区域试验还是复杂的全球试验,您都需要一个强大的供应链网络,其中包括对各国国情的熟谙,及与当地的监管机构有良好的沟通。精鼎医药可为客户提供知识、系统和关系网络,以实现端到端的临床试验供应链管理。我们将帮助您建立一个跨越国际障碍的供应链, 按时向患者和研究中心交付试验所用的药物。
为了确保我们的客户能够在世界各地自由地开展试验,我们运营着一个轴辐式临床供应链运营中心网络,可实现将药物和辅助用品无缝地运送到研究中心。我们拥有一支业务熟练的贸易合规专业团队,负责处理报关、许可证申请、与地方政府的协调等工作,以便您可以专注于为患者的未竟需求进行临床试验。
精鼎曾获得多项亚太生物工艺卓越奖,包括2021年最佳临床供应链奖、2020年最佳供应链数字化奖、以及2019年最稳健CRO供应链奖。
临床试验有一定的选择局限性,而非包容性,这严重影响到未被代表的患者群体。精鼎的使命是改变这种状况。我们与患者、照料者、医生和社区领导者直接沟通,向他们了解阻碍患者参与临床试验的因素。
无论您在试验设计过程中采取了哪些措施来解决公平性和包容性问题,我们都愿意在这方面与您展开合作。我们将帮助您进行试验设计,将那些因时间、金钱和交通等问题原本无法参与的患者纳入到试验中。随着包容性问题的解决,您将能帮助更多的患者,开发出更有效的药物和疗法。
通过TriNetX Live,我们能触达全球30多个国家数千万患者,帮助您联系到试验所需的不同人群。
现在需要把您的产品价值信息推向市场。在精鼎医药,我们将治疗的专业知识与专有的多渠道解决方案相结合,帮助您制定沟通和推广计划,将诠释产品价值的证据全面转化为合规的沟通方案。
通过简明而有科学证据的沟通、开展多渠道教育计划、以及工作在一线的医学沟通团队的努力,我们将达成对产品价值的共识,创建能影响利益相关方的沟通和共同认知,以此获得关键利益相关方的支持。
我们的专业医学撰稿人在多个治疗领域都有很丰富的经验,可以让医学沟通更具相关性和影响力。
在创新驱动型医药领域快速发展的背景下,确保药物安全变得日益复杂。来自多种渠道的海量数据使得安全信息管理比以往任何时候都更具挑战性。在精鼎医药,我们凭借近40年的专业经验来应对这些复杂挑战,为客户提供全方位的药物警戒服务,在产品的整个生命周期中优先考虑患者安全。我们的综合战略规划结合了尖端技术和人工智能(AI)驱动的解决方案,以提供具有可行性的洞察并简化流程。
我们拥有一支由3,000多名安全专业人士组成的全球安全专家团队,可支持广泛的治疗领域,确保监管合规和对患者安全的坚定承诺。探索我们的定制解决方案如何帮助您应对现代药物安全的挑战。
卓越运营
精鼎医药卓越运营和交付团队的目标是对试验的运营模式进行持续提升改进。通过汇集经验丰富的跨职能团队成员,我们在整个组织内创建了更优实践,这些实践加快了试验进展速度,帮助我们获得令人信服的试验证据,推动了创新,赋能我们用心(With Heart™)将最终成果交付给客户。