
临床前至早期临床研究的转化考量——提高药物进入人体试验后的最终成功率
随着我国自主新药研发能力的不断提升,我们看到越来越多的企业其核心产品从临床前到临床阶段转化的需求,这一过程往往需要各方专家的通力合作,包括来自于临床前、CMC、生物分析、临床药理、定量药理的专家,此外还需要对自身产品特点的完整认识和有效的风险评估。有统计表明,在过去10年中,进入 I 期临床 研究的创新药物最终能够成功实现上市的平均比率仅 为7.9%,其中血液药物成功率最高,达到了23.9%,紧随其后的代谢类药物的成功率则降到了15.5%。由此可见,顺利通过 I 期研究有如千军万马过独木桥,是决定药物能否继续研发的关键。
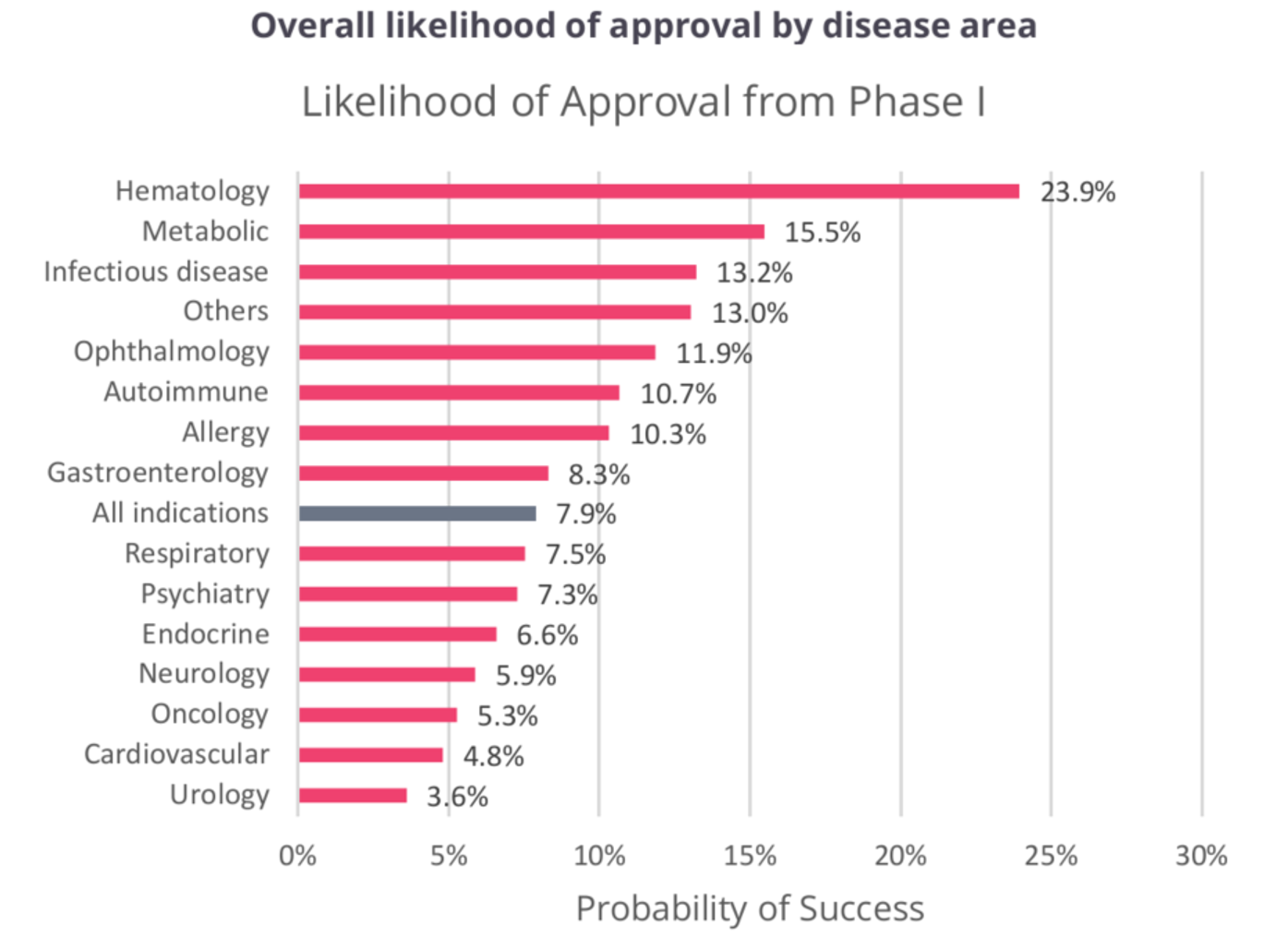
来源:Clinical Development Success Rates and Contributing Factors 2011–2020
我们会很想知道,哪些因素会影响药物进入人体试验后最终的成功率?是什么主要原因导致药物止步于早期研发阶段?如何提高成功率?
我们看到的很多早期失败原因可以归结为药代动力学问题、安全性问题,难以进行或无法实现概念验证 (Proof of mechanism)。其中安全性问题尤为值得注意。
随着我国加入国际人用药品注册技术协调会(ICH),国家药监局已经ICH所有“S”系列的指导原则,这意味着所有的临床前研究要求均已于国际接轨。“S”系列即 “安全性(Safety)”,指一整套规范临床前研究的指南, 包括小分子、大分子、肿瘤药、非肿瘤药,虽然对各类药物的要求有所差异,但总体原则是一致的。另外,ICHM3 (药品人类临床研究和上市批准中非临床安全性研究指南)也被我国所接受。之所以提及这些指南,是因为临床前研究的质量和发现是向人体试验转化的关键。 临床前研究和临床研究是高度关联的。仔细设计、认真解读的临床前数据能够为未来的临床研究提供充足的信息和研发信心。我们在支持各类药物从临床前至临床转化的过程中,会重点关注很多关键问题。
最常关注的问题包括以下几点:
主要药效学
次药效学
安全性药效学
毒理学
临床前药代动力学
免疫原性
生殖毒性
阅读该文章PDF详细了解全部内容。

